Câu hỏi 1 trang 26: Những phát biểu sau nói về đặc điểm của các hạt cấu tạo nên nguyên tử. Với mỗi phát biểu, hãy điền tên hạt phù hợp vào ô trống.
| Phát biểu | Loại hạt |
| (1) Hạt mang điện tích dương | ? |
| (2) Hạt được tìm thấy cùng với proton trong hạt nhân | ? |
| (3) Hạt có thể xuất hiện với số lượng khác nhau trong các nguyên tử của cùng một nguyên tố | ? |
| (4) Hạt có trong lớp vỏ xung quanh hạt nhân | ? |
| (5) Hạt mang điện tích âm | ? |
| (6) Hạt có khối lượng rất nhỏ, có thể bỏ qua khi tính khối lượng nguyên tử | ? |
| (7) Hạt không mang điện tích | ? |
Lời giải:
| Phát biểu | Loại hạt |
| (1) Hạt mang điện tích dương | Proton |
| (2) Hạt được tìm thấy cùng với proton trong hạt nhân | Neutron |
| (3) Hạt có thể xuất hiện với số lượng khác nhau trong các nguyên tử của cùng một nguyên tố | Neutron |
| (4) Hạt có trong lớp vỏ xung quanh hạt nhân | Electron |
| (5) Hạt mang điện tích âm | Electron |
| (6) Hạt có khối lượng rất nhỏ, có thể bỏ qua khi tính khối lượng nguyên tử | Electron |
| (7) Hạt không mang điện tích | Neutron |
Câu hỏi 2 trang 26: Điền thông tin thích hợp vào chỗ… trong mỗi câu sau:
a) Hạt nhân của nguyên tử được cấu tạo bởi các hạt…(?)…
b) Một nguyên tử có 17 proton trong hạt nhân, số electron chuyển động quanh hạt nhân là…(?)…
c) Một nguyên tử có 10 electron, số proton trong hạt nhân của nguyên tử đó là…(?)…
d) Khối lượng nguyên tử nguyên tố X bằng 19 amu, số electron của nguyên tử đó là 9. Số neutron của nguyên tử X là…(?)…
e) Một nguyên tử có 3 proton, 4 neutron và 3 electron. Khối lượng của nguyên tử đó là…(?)…
Lời giải:
a) Hạt nhân của nguyên tử được cấu tạo bởi các hạt proton và neutron
b) Một nguyên tử có 17 proton trong hạt nhân, số electron chuyển động quanh hạt nhân là 17
c) Một nguyên tử có 10 electron, số proton trong hạt nhân của nguyên tử đó là 10
d) Khối lượng nguyên tử nguyên tố X bằng 19 amu, số electron của nguyên tử đó là 9. Số neutron của nguyên tử X là 10
e) Một nguyên tử có 3 proton, 4 neutron và 3 electron. Khối lượng của nguyên tử đó là 7 amu
Câu hỏi 3 trang 26: Viết kí hiệu hóa học của các nguyên tố sau: hydrogen, helium, carbon, nito, oxygen, natri
Lời giải:
| Tên nguyên tố hóa học | Kí hiệu hóa học |
| Hydrogen | H |
| Helium | He |
| Carbon | C |
| Nito | N |
| Oxygen | O |
| Natri | Na |
Câu hỏi 4 trang 26: Mô hình sắp xếp electron trong nguyên tử của nguyên tố X như sau:
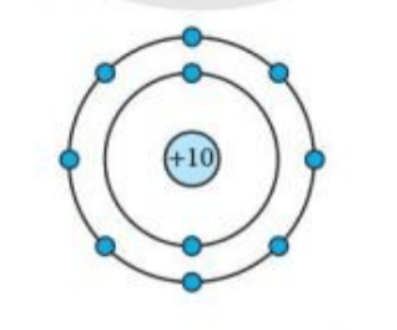
a) Trong nguyên tử X có bao nhiêu electron và được sắp xếp thành mấy lớp?
b) Hãy cho biết tên nguyên tố X
c) Gọi tên một nguyên tố khác mà nguyên tử của nó có cùng số lớp electron với nguyên tử nguyên tố X
Lời giải:
a) Mô hình cấu tạo nguyên tử X có: 10 hình tròn nhỏ màu xanh, 2 đường tròn xung quanh hạt nhân
=> Nguyên tử X có 10 electron và có 2 lớp electron
b) Nguyên tử X có điện tích hạt nhân = +10
=> STT của X trong bảng tuần hoàn là 10
=> X là Neon
c) Nguyên tố X có 2 lớp electron => Nằm ở chu kì 2 của bảng tuần hoàn
=> Nguyên tố cùng nằm ở chu kì 2 là: Oxygen, Nitrogen, Carbon…
Câu hỏi 5 trang 27: Hoàn thành những thông tin còn thiếu trong bảng sau:
| Tên nguyên tố | Kí hiệu hóa học | Nguyên tử của nguyên tố | |||
| Số proton | Số neutron | Số electron | Khối lượng nguyên tử (amu) | ||
| ? | ? | ? | 10 | 9 | ? |
| Lưu huỳnh | ? | ? | ? | 16 | 32 |
| ? | ? | 12 | ? | ? | 24 |
| ? | ? | 1 | ? | ? | 2 |
| ? | ? | ? | ? | 11 | 23 |
Lời giải:
– Hàng thứ 1: Số proton = số electron = 9, khối lượng nguyên tử = 10 + 9 =19, tên nguyên tố là fluorine, kí hiệu hóa học: F
– Hàng thứ 2: Số proton = số electron = 16, số neutron = 32 – 16 = 16, kí hiệu hóa học: S
– Hàng thứ 3: Số proton = số electron = 12, số neutron = 24 – 12 = 12, tên nguyên tố là Magnesium, kí hiệu hóa học: Mg
– Hàng thứ 4: Số proton = số electron = 1, số neutron = 2 – 1 = 1, tên nguyên tố là Hydrogen, kí hiệu hóa học: H
– Hàng thứ 5: Số proton = số electron = 11, số neutron = 23 – 11 = 12, tên nguyên tố là Sodium, kí hiệu hóa học: Na
| Tên nguyên tố | Kí hiệu hóa học | Nguyên tử của nguyên tố | |||
| Số proton | Số neutron | Số electron | Khối lượng nguyên tử (amu) | ||
| Fluorine | F | 9 | 10 | 9 | 19 |
| Lưu huỳnh | S | 16 | 16 | 16 | 32 |
| Magnesium | Mg | 12 | 12 | 12 | 24 |
| Hydrogen | H | 1 | 1 | 1 | 2 |
| Sodium (natri) | Na | 11 | 12 | 11 | 23 |
Câu hỏi 6 trang 27: Số proton và số neutron của hai nguyên tử X và Y được cho trong bảng sau:
| Nguyên tử | X | Y |
| Số proton | 6 | 6 |
| Số neutron | 6 | 8 |
a) Tính khối lượng của nguyên tử X và nguyên tử Y
b) Nguyên tử X và nguyên tử Y có thuộc cùng một nguyên tố hóa học không? Vì sao?
Lời giải:
a)
– Xét nguyên tử X có 6 proton và 6 neutron
=> Khối lượng nguyên tử X = 6 + 6 = 12 amu
– Xét nguyên tử Y có 6 proton và 8 neutron
=> Khối lượng nguyên tử Y = 6 + 8 = 14 amu
b) Nguyên tử X và nguyên tử Y đều có 6 proton trong hạt nhân
=> Nguyên tử X và nguyên tử Y đều thuộc 1 nguyên tố hóa học
Câu hỏi 7 trang 27: Cho các nguyên tố sau: Ca, S, Na, Mg, F, Ne. Sử dụng bảng tuần hoàn các nguyên tố hóa học:
a) Hãy sắp xếp các nguyên tố trên theo chiều tăng dần điện tích hạt nhân
b) Cho biết mỗi nguyên tố trong dãy trên là kim loại, phi kim hay khí hiếm
Lời giải:
a)
| Kí hiệu hóa học | Điện tích hạt nhân |
| Ca | +20 |
| S | +16 |
| Na | +11 |
| Mg | +12 |
| F | +9 |
| Ne | +10 |
=> Các nguyên tố theo chiều tăng dần điện tích hạt nhân: F, Ne, Na, Mg, S, Ca
Câu hỏi 8 trang 27: Dựa vào bảng tuần hoàn, hãy cho biết một số thông tin của các nguyên tố có số hiệu nguyên tử lần lượt là 12, 15, 18. Điền các thông tin theo mẫu bảng sau:
| Số hiệu nguyên tử | Tên nguyên tố | Kí hiệu hóa học | Khối lượng nguyên tử | Chu kì | Nhóm | Kim loại, phi kim hay khí hiếm |
| 12 | ? | ? | ? | ? | ? | ? |
| 15 | ? | ? | ? | ? | ? | ? |
| 18 | ? | ? | ? | ? | ? | ? |
Lời giải:
– Số hiệu nguyên tử là 12:
+ Tên nguyên tố: Magnesium (Mg), khối lượng nguyên tử là 24
+ Nằm ở hàng 3 => Chu kì 3
+ Nhóm IIA
+ Màu xanh => Kim loại
– Số hiệu nguyên tử là: 15
+ Tên nguyên tố: Phosphorus (P), khối lượng nguyên tử là 31
+ Nằm ở hàng 3 => Chu kì 3
+ Nhóm VA
+ Màu hồng => Phi kim
– Số hiệu nguyên tử là: 18
+ Tên nguyên tố: Argon (Ar), khối lượng nguyên tử là 40
+ Nằm ở hàng 3 => Chu kì 3
+ Nhóm VIIIA
+ Màu vàng => Khí hiếm
| Số hiệu nguyên tử | Tên nguyên tố | Kí hiệu hóa học | Khối lượng nguyên tử | Chu kì | Nhóm | Kim loại, phi kim hay khí hiếm |
| 12 | Magnesium | Mg | 24 | 3 | IIA | Kim loại |
| 15 | Phosphorus | P | 31 | 3 | VA | Phi kim |
| 18 | Argon | Ar | 40 | 3 | VIIIA | Khí hiếm |
Câu hỏi 9 trang 27: Biết nguyên tử của nguyên tố M có 2 electron ở lớp ngoài cùng và có 3 lớp electron. Hãy xác định vị trí của M trong bảng tuần hoàn (ô, chu kì, nhóm) và cho biết M là kim loại, phi kim hay khí hiếm
Lời giải:
– Nguyên tử M có 2 electron ở lớp ngoài cùng => M nằm ở nhóm IIA
– Nguyên tử M có 3 lớp electron => M nằm ở chu kì 3
=> M thuộc ô số 12, nằm ở nhóm IIA, chu kì 3
– Ô số 12 màu xanh => Nguyên tử M là kim loại.
